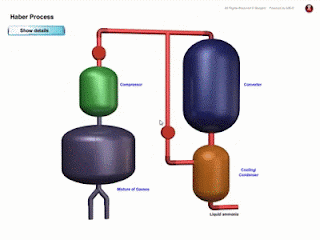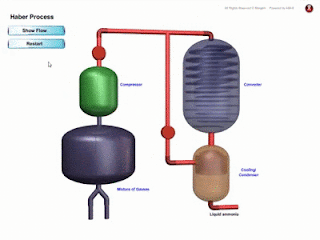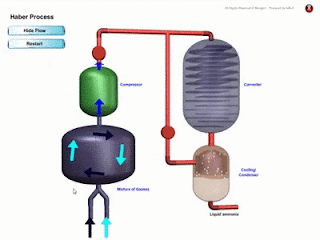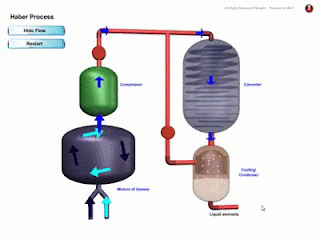
- Bahan komposit ialah bahan yang dihasilkan daripada gabungan dua ✌ atau lebih bahan-bahan berbeza seperti aloi, logam, kaca, polimer dan seramik.
- Sifat-sifat bahan komposit adalah lebih baik 👍 daripada komponen asalnya.
Kegunaan Komposit
1. Jenis Bahan Komposit : Konkrit yang diperkukuh
Komponen : Simen, batu kerikil, pasir, air, besi atau keluli
Sifat Istimewa :
- Lebih kuat 👊 dan keras
- Tahan beban yang berat 💯
- Mudah diacukan kepada pelbagai bentuk
Kegunaan : Digunakan untuk membina bangunan yang tinggi 🌁, jambatan dan pelantar minyak
2. Jenis Bahan Komposit : Superkonduktor
Komponen : Kuprum (II) oksida, barium karbonat dan natrium oksida dipanaskan membentuk sejenis seramik dikenali sebagai perovoskit
Sifat Istimewa : Tiada rintangan elektrik
Kegunaan : Digunakan dalam kereta api laju 🚅, sistem penyimpanan tenaga bermagnet, generator, transformer dan cip komputer 💻
3. Jenis Bahan Komposit : Gentian optik 🔌
Komponen : Kaca, kuprum dan aluminium
Sifat Istimewa :
- Dapat menghantar data 📲 dalam kapasiti yang tinggi dan cepat ⚡
- Stabil secara kimia dan kurang gangguan interferens
Kegunaan :
- Digunakan dalam kabel komunikasi 📞
- Digunakan dalam endoskop untuk memeriksa organ di dalam badan manusia 👨
4. Jenis Bahan Komposit : Gentian kaca 🚴
Komponen : Plastik yang diperkukuh dengan gentian kaca
Sifat Istimewa :
- Mempunyai kekuatan regangan yang tinggi
- Mempunyai ketumpatan yang rendah
- Mudah diwarnakan
- Mudah diacukan dan dibentukkan
Kegunaan : Digunakan untuk membuat tangki penyimpan air 💧, raket badminton, bot 🚣dan papan peluncur salji 🏂
5. Jenis Bahan Komposit : Kaca fotokromik 👓
Komponen : Bahan fotokromik seperti argentum klorida digabungkan dengan kaca atau polimer lut sinar
Sifat Istimewa : Peka terhadap cahaya 🌞
Kegunaan : Digunakan untuk membuat kanta optik 🔍, tingkap kereta 🚘, tingkap bangunan 🏢, panel paparan maklumat 📺, kanta kamera 📷, suis optik dan meter untuk mengukur keamatana cahaya